OKSİJEN; Aim. Saurestof (m), Fr. Oxygène (nı), İng. Oxygen. Elementler içinde çok bol bulunanı olduğu hâlde, eski kimyâcıların gözünden kaçan renksiz, kokusuz ve tatsız bir gaz. İlk defâ 1774 yılında J.Priestley tarafından, cıva oksidin ısıtılması ile elde edildi. 1781’de Lavoisier, oksijenin, havada bulunan ve yanmayı hâsıl eden bir madde olduğunu bildirdi. Bu maddeye, asit yapısı anlamına gelen oxy- gemum ismini verdi. Çünkü Lavoisier, bütün asitlerin oksijen ihtiva ettiğini sanıyordu.

Bulunuşu: Atmosfer, hacim olarak % 21, ağırlıkça % 23,2 oksijen ihtivâ eder. Su, ağırlıkça % 8 8 , 8 oksijen bulundurur. Yer kabuğunun ise % 50’sini teşkil eder. Oksijen, serbest hâlde, havada, suda, çözünmüş olarak ve topfrak içinde en çok nitrat, fosfat ve karbonat hâlinde yer kabuğu içinde bulunur.
Özellikleri: Kimyada “O” sembolüyle gösterilir. Atom numarası 8 olan oksijenin tabiatta kütle numaraları 16 (% 99,76), 17 (% 0,04) ve 18 (% 0,20) olan üç izotopu vardır. Oksijenin atom ağırlığı 16 olarak kabul edilir. (Karbon atomunun ağırlığı 1 2 kabul edildiği zaman, oksijenin atom ağırlığı 15,9994’tür). Kütle numaraları 14, 15 ve 19 olan izotopları radyoaktiftir. Fakat bu radyoaktif izotopların ömrü oldukça kısadır. Yarılanma müddetleri; 0l4’ün 72 saniye, 0l5’in 2,1 dakika 0,9’un ise 29 saniyedir. Oksi jenin çekirdeğinde 8 proton bulunmaktadır. İki yörüngesi olan oksijenin en dış yörüngesinde altı elektron bulunmaktadır. Kimyâ reaksiyonlarının hemen hemen hepsinde iki elektron alarak (2-) hâle geçer. Oksijen, normal sıcaklıkta pasif olduğu hâlde, yüksek sıcaklıkta aktiftir.
Serbest hâlde 0 2 moleküler yapısına sâhip olan oksijen havadan 1,1053 defâ daha ağırdır. Oksijenin sudaki çözünürlüğü, 100 mİ suda 2,8 ml’dir (20°C). Bu çözünme olayı balıklar için za- rûridir. Oksijenin kritik sıcaklığı -118,8°Cdır. Oksijen, bu sıcaklığın üzerinde sıvılaşmaz. Yâni sâdece basınçla sıvılaştırılamaz. Oksijenin kritik basıncı 49,7 atmosferdir. Bir atmosfer basınçtaki erime noktası -218,8°C ve kaynama noktası -183°C’dir. Belli miktardaki oksijen, katı ve sıvı hâllerinin her ikisinde de şeffaf ve açık mavidir. Sıvı oksijen, kuvvetli manyetiktir. Şâyet sıvı oksijenin bir atmosfer basıncındaki bir hacmi, normal şartlar altında (760 mm Hg ve 20°C) bu- harlaştırılırsa, buharın hacmi, sıvı hacminin 860 misli olur. Katı oksijenin yoğunluğu -252,5°C’de 1,426 g/cm3tür. Sıvı oksijenin yoğunluğu -183°Cde 1,143 g/cm3 tür. 0°C’deki gaz oksijenin yoğunluğu 1,429 g//’dir. Metallerin çok azı, sıvı hâldeyken oksijen absorblar (emer). Absorblanan bu oksijen, metal katılaşırken tekrar metali terk eder. Bileşikleri: Oksijenin en önemli bileşiği sudur (H2 0). Kükürt dioksit (S02) ve karbondioksit (C02) gibi ametal oksitler; alkol, aldehit ve karboksilli asitler gibi organik bileşikler; sülfürik asit (H2 S04), nitrat asidi (HN03) gibi mineral asitler oksijenin kovalent bağ oluşturduğu bileşiklerdir. Oksijenin metallerle yaptığı bileşikler iyonik bileşiklerdir. Tabiatta bulunan birçok kıymetli mineral, (hematit (Fe2 0 3), küprit (Cu2 0), alumin (A12 0 3) kalsiyum oksit (CaO) gibi) oksijen ihtivâ eder.
Elde edilişi:
1. Suyun elektrolizinden elde edilir. Az miktarda baz veya asit ilâve edilmiş saf su elektroliz edilirse, anotta, çok saf oksijen elde edilir.
2. Laboratuvarda, potasyum kloratm (KC103) mangandioksit (Mn02) ile ısıtılmasından elde edilir.
3. Potasyum permanganat ile hidrojen peroksit, asitli ortamda oksijen verir.
4. Endüstride, havadan elde edilir. Hava, sıvı hâle getirilir. Sıvı havanın franksiyonlu destilas- yonunda önce azot buharlaşır, geriye % 99,5 saflıkta oksijen kalır.
5. Yine endüstride, çok saf oksijen, baryum peroksidin (Ba02) 800°ye kadar ısıtılmasından elde edilir. ;
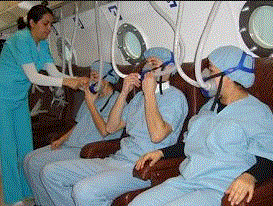
Kullanılışı: Hidrojen ve asetilen gibi yanıcı gazlarla birleştirilerek kaynakçılıkta kullanılır. Bu alevin sıcaklığı yaklaşık 4000°C olduğu için, metal yüzeylerini eriterek, metalleri birbirine mevzi alarak birleştirir. Bu sıcaklıktan faydalanılarak, metaller ve çelikler kesilir. Kaynakçılıkta ve kesme işleminde kullanılan oksijen, % 95,5 saflıktadır. Bu oksijen, tıpta oksijen tedâvisinde kullanılır. Roketlerin tahrikinde, dalgıçların şu altında çalışmalarında, su gazı imâlinde, yüksek fırınlarda sentetik taşların imâlinde, kimyevî sentezlerde kullanılır.
Oksijen çevrimi: Oksijenin değişik biçimlere dönüşerek tabiatta devamlı dolaşımıdır. Oksijen havada gaz hâlinde suda ise bileşik olarak bulunur. İnsanlar, hayvanlar ve bâzı bitkiler teneffüs yoluyla aldıkları oksijeni karbondioksit hâlinde havaya veya suya geri verirler. Daha sonra algler ve yeşil bitkiler aldıkları karbondioksidi fotosentez yoluyla karbonhidratlara dönüştürürler. Bu arada yan ürün olarak da oksijen açığa çıkar. Dünyâdaki sular biyosferin başlıca oksijen kaynağıdır. Mevcut oksijenin yaklaşık yüzde 90’ının sularda yaşayan alglerce karşılandığı tespit edilmiştir. Tabiattaki hâdiseler atmosferdeki oksijen miktarının sâbit kalmasına ve böylece hayâtın devam etmesine imkân sağlayacak şekilde tezâhür eder