ATOM; Alm. Atom, Fr. Atome, İng. Atom. Maddenin
en küçük ve temel yapı taşı. Atom, içinde organize
tânecikler bulunan ve bunlara bölünebilen
yine de maddenin temel yapı taşı olarak bilinen bir
birimdir. Bütün maddeleri meydana getiren (madde,
boşlukta yer kaplayan ve ağırlığı olan varlık demektir.)
105 çeşit element bilinmektedir. Element,
kendisinden başka özellikte maddeler çıkarılmayan
saf madde demektir. İşte bu elementlerin her birini
meydana getiren en küçük yapı taşları atomlardır.
Aynı cins atomlar elementi meydana getirir.
Meselâ hidrojen ve demir birer elementtir. Çünkü
yapılarında birer çeşit atom vardır. Farklı atomların
bir araya gelmesinden oluşan maddelere bileşik
diyoruz. Su element değil, bir bileşiktir. Oksijen
ve hidrojen atomlarından meydana gelmiştir.
Su, toprak, ateş, etrâfımızdaki bütün maddeler,
bu 105 çeşit elementin, yâni bunların yapı taşı
olan atomların muhtelif şekillerde bir araya gelmesi
ile teşekkül etmişlerdir.
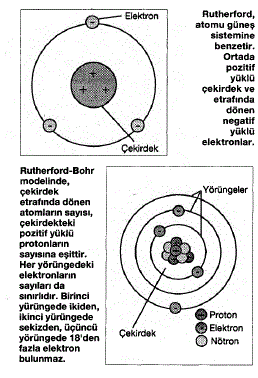
Atom teorileri: Rutherford (1911), ince bir
mâden (altın) levhadan alfa tânecikleri geçirdi.
Alfaların çoğu, serbestçe doğru geçip binde biri,
yolundan saptı. Mâdenler atom şebekesi olduğundan,
alfaların doğru geçmesi atomların içinin
boş olduğunu göstermektedir. Demek ki atomların
ortasında, atomun artı elektrik yükünü ve aynı zamanda
bütün kütlesini hâvi bir çekirdek vardır.
Bu çekirdeğin çapı atomun tekmil çapından yüz bin
defâ daha küçüktür. Atomlar elektrikçe nötr olduğu
için, çekirdek etrafında, çekirdekteki artı elektrik
kadar elektron bulunması lâzımdır.
Rutherford, atomları planet modeline benzeterek,
elektronların boşlukta gelişigüzel hareket ettiklerini
ileri sürdü. Ancak bu model, elektronların
yörüngelerindeki ivmeleri dolayısıyla zamanla
enerjilerini kayıp ederek, çekirdek üzerine düşmeleri
gerekeceği sorusuna cevap veremedi. Bu somya
1913 yılında Bohr, quanta yörünge modelini
geliştirerek cevap verdi. Bohr, elektronların çekirdek
çevresinde belirli yörüngelerinin olduğunu
ve bir yörüngeden diğerine ganta atlamaları şeklinde
geçtiklerini ileri sürdü. De Broglie, Bohr
modelinin ortaya koyduğu serbest yörüngeleri, o
andaki elektronun madde dalgasının kendi içinde
kapalı olarak titreştiği ve böylece duran dalgaların
meydana geldiği alanlar olarak açıkladı. Fakat bu
madde dalgası fikri ile de atom yapısına fiziksel bir
berraklık getirilemedi.
De Broglie’nin fikirlerinden hareket eden
Schrödinger ve Heisenberg (1927) muhtelif matematik
ifadelerle modern atom teorisini ortaya
koymuşlardı. Bu teoriye göre, elektron için çekirdek
etrâfında belirli bir yol ve yörünge yoktur.
Ancak elektron orbital veya yük bulutu adı verilen
alanlarda bulunabilir. Elektronun bulunma ihtimâlinin
olduğu bölgeler Schrödinger’in ortaya
koymuş olduğu dalga fonksiyonunun mutlak karesi
alınarak bulunabilir.
Bugün bilinen yapıya göre atom, artı elektrik
yüküne sâhip protonların ve yüksüz nötronların bulunduğu
bir çekirdek ile, çekirdek etrâfındaki eksi
elektrik yüküne sâhip elektronlardan meydana
gelmiştir. Bir atomdaki proton ve elektron sayıları
birbirine eşit olduğunda atom nötrdür. Artı ve eksi
yükler arasındaki çekim, elektronları çekirdeğe
yakın tutar.
Atomun büyüklüğü: Atomun yarıçapı yaklaşık
10″8 santimetredir. 56 gram demir içinde
6,012.1023= 602.000.000.000.000.000.000.000 tâne
atom bulunmaktadır. Çekirdeğin yarıçapı 10’13santimetredir. Yâni çekirdeğin çapı atomun çapından
100.000 defâ daha küçüktür. Şöyle ki bir
atomun içini tamâmen çekirdek ile doldurabilmek
için 1015 çekirdek gerekir. Büyük bir stadyum ve
bunun ortasında bir böcek. Atom ve çekirdeği için
böyle bir örnek vermek mümkündür. Böcek atomun
çekirdeği ise, elektronların bulunduğu yörüngeler
stadyumun duvarlarıdır. Böyle olmasına
rağmen atomun hemen hemen bütün kütlesi
çekirdekte toplanmıştır. Eğer atomdaki bu büyük
boşluk olmasaydı, yâni elektronlar bir an için durup
dönmeselerdi, dünyâmız bir ev kadar küçük
olurdu. Bir çay kaşığı su 1015 gr (1 milyar ton)
ağırlıkta olacaktı. Böylece kendi vücudumuz dâhil
olmak üzere, etrafta görebildiğimiz ne varsa
hepsinin hemen hemen birer boşluklar âleminden
ibâret olduğunu söylemek doğru olacaktır. Atomun
insan büyüklüğü yanındaki hacmi, insanın güneş
büyüklüşüne nisbeti gibi olup, bu nispet 1028dir.
Yâni 1028 adet atom bir insanı, 1028 tâne insan da
güneşi meydana getirir. İnsanın kâinattaki yeri
güneş büyüklüğü ile atom büyüklüğü ortasındadır.
Proton, nötron, elektron: Önceleri atom,
maddenin son durağı bilinirdi. Daha sonra bölünemez
sanılan atomda proton, nötron, elektron,
mezon, nötrino gibi kütleli veya kütlesiz düzinelerce
parçacık keşfedilmiştir. Nötron ve proton
atom çekirdeğini teşkil eden parçacıklardır. Kütleleri birbirine yakındır. Protonların kütlesi
1,673.İO’24 gram, nötronların ise 1,675.10 24 gram
kadardır. Herbirinin kütlesi elektronun 1836 misli
kadardır. Nötronlar elektrikçe yüksüz tâneciklerdir.
Protonlar ise +1 (bir birim pozitif elektrik)
yüklüdür. Çekirdekteki proton sayısı kadar +yük
mevcut olur. Atomun nötr olması, çekirdek dışındaki
elektronların sayısının proton sayısı kadar
olmasındandır. Elektronlar, kütlece çok küçük olmalarına
rağmen -1 (bir birim negatif elektrik)
yüklü olmaları, protonun + yükünü nötrleştiriyor.
Bir atomun çekirdeğindeki proton sayısı atomun
numarasını, proton ile nötron sayısı toplamı
ise atomun kütlesini verir. Atom numarası aynı
zamanda elektron sayısı kadardır. Elektronlar atom
çekirdeği etrâfında gezegenlerin güneşin etrâfında
döndüğü gibi dönerler. Nasıl ki güneşe en yakın
gezegenin hızı en fazla ise çekirdeğe yakm
elektronların hızı da en fazladır. Elektronların çekirdekten
uzaklıkları, bir milimetrenin milyonda
biri kadardır. Böylece sâniyedeki hızları 1000-
150.000 km olan elektronlar çekirdek etrâfında
küçücük yollarında milyarlarca defâ dönmektedirler.
Elektron hızında giden bir tren sâniyede Haydarpaşa’dan
Erzurum’a birkaç kere gidip gelebilir.
İşte elektronların bu yüksek hızından dolayı
atomların içi dolu gibi görünüyor. Boşluklu olduğu
halde, maddelerin içinin dolu sanıldığını,
ilk olarak bulan ve kitablarında yazan, başta Mektûbât
olmak üzere birçok kıymetli kitabların yazan
büyük İslâm âlimi İmâm-ı Rabbânî Ahmed Fârûkî
Serhendî hazretleridir.
Atomu organize halde tutan kuvvetler: Atomu
gerek kendi içinde muhâfaza etmekte, gerekse
diğer atomlarla olan hareketlerini düzenlemede
dört kuvvet rol oynar. Çekim kuvveti, zayıf kuvvet,
elektromanyetik kuvvet ve nükleer kuvvet.
Gezegenleri güneş sisteminde tutan kuvvet, çekim
kuvvetidir. Aynı tür kuvvet atom ve molekülleri
bir arada tutan kuvvettir. Çekirdek etrâfında
korkunç bir hızla dönen elektronların kaçıp
gitmelerini önleyen kuvvet elektromanyetik kuvvettir.
Bu kuvvet ters işâretli elektrik yüklerinin birbirini
çekmesi şeklinde tezâhür eder. Çekirdekte
bulunan protonların aynı işârette elektrik yükü ile
yüklü bulunmalarına rağmen, birbirlerini itmeyip,
bilâkis çok yakm durmalarını gerçekleştiren
kuvvet nükleer kuvvettir. Bu kuvvetler birbiri ile
kıyas edilemiyecek kadar farklı şiddetlerde oldukları
hâlde atomu büyük bir düzen ile kurarlar.
Periyodik sistem: 1867 senesinde Mendelyef
ve Lothar Meyer isminde iki kimyâger, birbirinden
haberi olmadan 105 elementten, o gün bilinenleri,
atom ağırlığına göre soldan sağa doğru
sıra ile yazmış, birkaç elementten sonra gelenlerinkimyâ özelliklerinin tekrar baştakilere benzediğini
görmüş, bunları baştakilerin altına yazmıştır.
Böylece yedi satır meydana gelmiştir. Her satıra
devre (periyod) denir. Alt alta olan elementlerin
kimyâsal özellikleri aynıdır. Bunlara, yukarıdan
aşağı, bir grup denir. Yan yana sekiz grup vardır.
Yüz beş elementin yedi devir ve sekiz grup teşkil
etmek üzere sıralanmasına periyodik sistem (veya
devr-i tasnif) denir.
: Elektron yörüngeleri: Elementlerde basitten
karmaşığa doğru gidildikçe proton sayısı artmakta,
dolayısıyla çekirdeğin pozitif elektrik yükü
de fazlalaşmaktadır. Elektron sayısının da bu
oranda artacağıvmeydandadır. Nitekim atom numarası
1 olan hidrojenin 1 proton ve 1 elektronu
vardır. Atom numarası 2 olan Helyumun 2 proton
ve 2 elektronu vardır. 92 numaralı uranyumun 92
protonu ve 92 elektronu vardır.
Bir atomun bütün protonları çekirdekte bulunurken,
elektronların atomdaki mevzilenme durumları
oldukça komplekstir. Elektronlar çekirdeğin
etrâfında belli mesâfelerdeki yörünge gruplarına
belli sayılarla yerleşirler. Her yörünge grubunun
elektron kapasitesi bellidir. Yörünge gruplarına
elektron zarfı veya tabakası ismi verilir.
Elektron zarflan içten dışa doğru K,L,M,N,0,… diye
isimlendirilir. Her bir zarfın alabileceği maximum
elektron miktan zarf numarasının karesini iki
ile çarpmak sûretiyle bulunabilir.
K zarfı: 2 . I2 = 2 elektron
L ” : 2 .2 2= 8
M ” : 2. 32= 18
N ” •: . 2 . 42 = 32 ” . , •
Bu zarflar ayrıca alt yörüngelere ayrılır. Bunlar
da içten dışa doğru s,p,d,f harfleri ile temsil edilirler.
Bir zarfta bulunan elektronlar bu alt yörüngelere
dağılmıştır. Hidrojen atomunun tek elektronu
K zarfında, helyum atomunun ikinci elektronu
yine K zarfında, Helyum atomunun ikinci
elektronu yine K zarfında, lityum ise 3 elektronlu
olduğundan, 3’üncü elektronu K zarfına sığmayıp,
L zarfının ilk yörüngesi s’ye yerleşir. 6 elektronlu
karbon atomunda K ile L zarflarının iki alt zarfı
(İs, 2s ile temsil edilirler) ikişer elektron aldığından,
kalan iki elektron L zarfının p alt yörüngesine
geçer. s,p,d ve f alt zarflannın da maksimum
elektron alabilme kapasiteleri sırasıyla 2,6,10 ve
14’tür.
Atomların en dıştaki zarfında 8’den fazla elektron
bulunmaz. Sekizden fazla olanlar bir sonraki
zarfa geçer. Meselâ potasyumun 19 elektronu vardır.
2’si K zarfında, 8’i L zarfında bulunur. Geriye
kalan 9 elektronu M zarfında yer alabileceği halde,..
sadece 8’i M zarfında kalır, kalan tek elekr
tro^N zarfına geçer. Son zarfında 8 elektron bulunan
atomlar kararlı atomlardır. Bu yüzden atomatomlar
bu kararlı hâle geçmek için ya elektron alma veya
verme eğilimi gösterir. İşte bu eğilim yüzbinlerce
çeşit bileşiğin teşekkülüne sebeb olur. Meselâ
sodyum’un M zarfında 1 elektronu vardır, klorun
ise M zarfında 7 elektronu vardır. Sodyum atomu
1 fazla elektronunu 1 eksik elektronu bulunan klor
atomuna verirse, her ikisi de kararlı hâle gelir. Bu
alışveriş sonucu sodyum atomu elektrikçe nötr
halden çıkar, pozitif yüklü bir iyon (katyon), klor
ise negatif yüklü bir iyon (anyon) olur. Bu iki zıt
yükün çekim kuvveti sonucu sodyum ve klor atomu
birleşerek sodyum klorür (NaCl) denilen bileşiği
(yemek tuzu) meydana getirirler.
Atom ağırlığı: Bir elementin bir atomunun
ağırlığıdır. Meselâ 6,02.10 23 tane hidrojen atomu
1 gr geldiğinden 1 tek hidrojen atomunun ağırlığı
1/6,02.10 23 gr olur. Bu rakam oldukça küçük olduğundan
genellikle Avagadro sayısı (1 mol) kadar
atomun ağırlığından söz edilir. Böylece 1 mol
Fe atomu 56 gr, 1 mol oksijen atomu 16 gr olur.
Atom kütlesi: Bir kimyasal elementin atomlarının
ortalama kütlesinin standart bir kütleye
oranıdır. Söz konusu standart kütle 1961’de karbon-
12 izotopunun bir atomunun kütlesinin 1/12’si
olarak seçilmiştir. Buna atomik kütle birimi (akb)
denir. Böylece hidrojenin atom kütlesi 1, oksijenin
atom kütlesi 16 ve demirin atom kütlesi 56 olur.
Atom numarası: Elementlerin çekirdeklerindeki
proton sayısına göre küçükten büyüğe doğru
sıralandıkları periyodik tabloda, her elementin
sıra numarası. Yüksüz bir atomda elektronların
sayısı protonların sayısına eşit olup, bu sayı atom
numarasıdır. Meselâ, 7 protonu bulunan azotun
atom numarası 7, 8 protonu bulunan oksijenin
atom numarası 8’dir.
ATOM