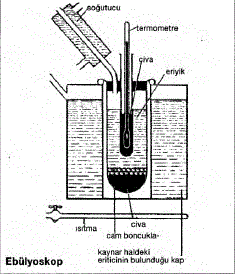
EBÜLYOSKOPİ; Alm. Ebullioskopie, Fr.
Ebullioscopie, İng. Ebullioscopy. Bir çözeltinin
kaynama noktasının yükselmesine (saf çözücüye
göre) dayanarak çözünmüş maddenin molekül tartısını
tâyin etme metodu.
Bir çözücüde uçucu olmayan maddelerden biri
çözünecek olursa, çözünen madde çözücüyü
seyreltir. Çünkü çözücü moleküllerinin bir kısmı
çözünen maddenin solvatasyonu için sarf edilmiş
ve hacim biriminde çözücü molekül sayısı azalmıştır.
Çözünen maddenin cinsi ne olursa olsunmiktarı çoğaldıkça çözücü o kadar seyreltilmiş
olur. O hâlde çözünen maddenin molar konsantrasyonu
ne kadar büyürse, çözücü konsantrasyonu
dolayısıyla çözücünün buhar basıncı saf çözücüye
nisbetle o kadar azalır. Kaynama noktası, sıvı
fazın buhar basıncının dış basınca eşit olduğu sıcaklık
olduğu bilindiğine göre çözelti saf çözücüden
daha yüksek bir sıcaklıkta kaynar.
Kaynama noktasındaki artış miktarı, çözünmüş
maddenin molar konsantrasyonu ile her bir çözücü
için ayrı bir değeri olan “molar kaynama noktası
yükselmesi sâbiti”nin çarpımına eşittir.
Dt = Kb m
Yukarıdaki eşitlikle Dt kaynama noktası yükselmesindeki
artış miktarı, Kb molar kaynama
noktası yükselmesi sâbiti, m ise çözünmüş maddenin
molaritesidir. Molarite 1 kg çözücü başına
çözünmüş madde mol sayısı olup şöyle-hesaplanabilir:
1000 g
m“ ğ m T
Burada g çözünmüş maddenin gram miktarı, G
çözücünün gram miktarı, M ise çözünenin molekül
tartısıdır. Birinci denklemde m’ninyerine eşiti
konursa:
denklemi elde edilir. Kaynama noktası yükselmesi
(Dt), çözünmüş madde gramı (g) ve çözücünün
gram miktarı (G) bilinirse, çözünmüş maddenin
molekül tartısı bulunabilir. Çünkü Kb sabit olup her
çözücü için bir değeri vardır. Meselâ, su için 1,86’dır.Ebülyoskopi usûlü özellikle organik maddelerin
molekül tartıları tâyininde çok büyük rol oynar.
Anorganik maddeler iyonlaştıkları için bu usûle
pek uygun değildirler. Yâni çözündükleri zaman
moleküler yapıda kalan maddeler için kullanılır.
EBÜLYOSKOPİ