OSMOZ (GEÇİŞME) OLAYI; Aim. Osmose
(f), Fr. Osmose (f), İng. Osmosis, osmose. Bir sıvının,
yarı geçirgen (semipermeabl) bir zardan
geçmesi olayı. Yoğunlukları (veya konsantrasyonları)
farklı olan iki çözelti, birbirinden yarı
geçirgen bir zarla ayrıldıklarında, iki tarafın yoğunluklarını
denge hâline getirmek için, zar içinden
bâzı iyon veya moleküller, bir taraftan diğer tarafa
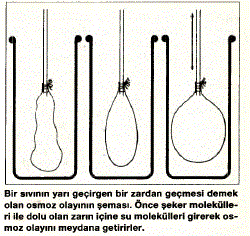
geçerler. Meselâ, bir kap yarı geçirgen birzarla iki kısma bölünüp bir tarafa boyalı su, diğer
tarafa da şekerli su konsa, biraz sonra renkli suyun
zardan geçerek şekerli suya karıştığı görülür. Bu,
osmoza bir misâldir. Şeker (sükroz) molekülleri,
zardan geçemeyecek kadar büyük oldukları için
kendi bölgelerinde kalır. Osmozda esas geçiş, daha
seyreltik olan çözeltiden (veya saf çözücüden)
daha konsantre olan çözeltiye doğru olur. Osmoz,
fiziksel bir olay olup özel bir difüzyon şeklidir. Biyolojide
yarı geçirgen bir zardan suyun difüzyonuna
“osmoz” denir.
Osmotik basınç: Su içinde çözünmüş maddelerin
hareketi, gaz moleküllerinin hareketi gibidir.
İşte bu tâneciklerin çözücü moleküllerinden ayn olarak
bulundukları kaba yaptıkları kısmî baskıya osmotik
baskı adı verilir. Bir çözelti yarı geçirgen
bir zarla çevrildiğinde, çözücü molekülleri zardan
serbestçe geçer, fakat çözünmüş madde molekülleri
geçmez ve zara tıpkı gaz molekülleri gibi bir baskı
yapar. Eğer yarı geçirgen zar esnek ise çözünmüş
madde tanecikleri tıpkı bir gazm balonu şişirmesi gibi
zarı şişirir. İşte osmotik basınç adı verilen bu
basıncın kantitatif incelenmesi J.H. Van’t Hoff tarafından
yapılmış ve ideal, yâni seyreltik çözeltilerde
gaz kânunlarına uyduğu tespit edilmiştir. V hacim,
T mutlak sıcaklık, n mol sayısı ve R gaz sâbiti olmak
üzere, osmotik basınç, P;
nRT
P=———-
V
denklemiyle bulunur. Çözeltinin, osmotik baskısı
ölçülerek molaritesi ve buradan çözünmüş maddenin
molekül tartısı tâyin edilebilir (gazlarda olduğu
gibi). Nitekim hemoglobinin 68.000 olan
molekül tartısı ilk defâ, osmotik basınç ölçülmesiyle
tâyin edilmiştir.Osmotik basınç, çözücü moleküllerin durumlarını
tâkip etmekle de açıklanabilir. Bilindiği gibi
su molekülleri de devamlı kinetik hareketler
yaparlar ve yarı geçirgen zardan içeri doğru geçerek
çözelti içine doğru durmadan geçerler. Saf
çözücüde zardan geçerek çözelti içine diffüze olan
moleküllerin sayısı, çözeltiden saf çözücüye geçen
moleküllerin sayısından daha fazladır. Bir başka
ifâdeyle, saf çözücüden zarı geçen su moleküllerinin
diffüzyon basıncı, çözeltiden geçen su moleküllerinin
diffüzyon basıncından büyüktür. Çünkü
çözelti içinde çözücü, çözünen madde ile seyreltilmiş
durumdadır. Diffüzyon basıncı farkı (DP),
osmotik basınca eşittir.
Canlı hücrelerde osmoz: Canlı bir hücrenin
kendi içindeki maddelere göre daha yoğun tuz ihtivâ
eden bir çözeltiye konduğu düşünülürse, böyle
bir durumda hücre içinde birim hacimde bulunan
su molekülü sayısı, hücre dışında aynı birim
hacimde bulunan su molekülü sayısından daha
fazla olduğundan, su, hücrenin içinden hücrenin dışına
doğru hareket edecektir. Böyle bir olayda suyun
hareketi doğrudan doğruya tespit edilemez. Fakat
olay mikroskop altında incelenirse, su kaybı sonucu,
hücrenin yavaş yavaş büzülüp küçüldüğü
görülür. Bunun aksine olan olayı, bir damla kanı
damıtık suya koyarak mikroskop altında incelemekle
görmek mümkündür. Normal olarak alyuvarlar
az da olsa, bir miktar tuz taşırlar. Damıtık su
ise tuzdan arınmıştır. Böyle bir durumda, suyun hareketi
zarın dışından zardan içeriye (hücrenin içine)
doğru olacaktır. Neticede hücreler şişecek ve
iç basınç çok artarsa zar patlayacaktır. Hücreler
kendi normal çevreleri içinde bulundukları zaman
iç ve dış çevrelerindeki maddelerin konsantrasyonu
arasında o kadar büyük bir fark yoktur. Normal
şartlar altında hücrelerde osmoz görülür, fakat
hücreleri parçalayacak derecede şiddetli bir iç basınç
olmaz.
Bir hücre çok yoğun bir çözelti içerisine bırakılacak
olursa, su moleküllerinin hücre içerisinden
dışarıya doğru hareketiyle protoplazma
çeperden ayrılarak büzülür. Bu olaya plazmoliz
denir. Eğer bir hücre uzun müddet plazmoliz
hâlinde tutulursa ölür. Henüz ölmeden saf su
içine bırakılırsa, bu durumda su hücreye girer ve
hücre eski hâline döner. Buna da deplazmoliz denir.
Osmozun özellikle biyokimyâda önemi çok
büyüktür. Kan ve lenfin osmotik baskısı dâimâ
sâbittir. Bu değer % 0,9’luk bir NaCl (Sodyum
klorür) çözeltisinin osmotik baskısına eşittir ve
% 0,9’luk NaCl çözeltisine, serum fizyolojik veya
isotonik çözelti denir. Kırmızı kan yuvarları saf su
ile işleme sokulursa, osmozdan dolayı derhal şişer
ve patlar (hemoliz).
OSMOZ (GEÇİŞME) OLAYI
21
Eki
