amfoterlik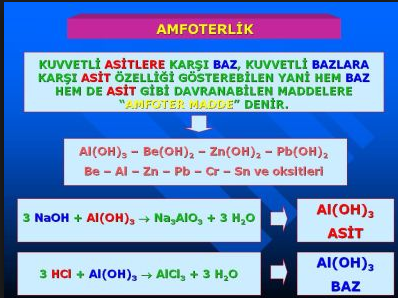
Kimyada bir maddenin, hem asit, hem de baz çözelti
lerle tepkimeye girebilme özelliği. Amfoter maddeler,
çözelti içinde bazlar karşısında hidrojen iyonları vere
rek asit gibi ya da asitlerden hidrojen iyonları alarak baz
gibi davranırlar.
Bazı metal elementlerin oksitleri ya da hidroksitleri
amfoterdirler. Asitlerle tepkimeye girerek (baz işlevi
görürler) normal tuzlan oluştururlar; bazlarla tepkime
ye girerek (asit işlevi görürler) içinde metal iyonunun
negatif yüklü karmaşık bir iyonla birleşmiş olduğu tuzla
rı oluştururlar.
Amfoter tuzlara bir örnek disodyum asit fosfattır
(Na2HP04); Na+ iyonları vermek için çözünür ve geri
de
HPO4-
kalır. Çözeltinin asitliğine (pH) bağlı olarak
iyonlar H+ ve P043′ olarak ayrılır ve asit işlevi görürler ya
da ek bir H+ iyonuyla birleşerek H2P04′ oluşturur, baz
işlevi görürler.
amfoterlik

09
Tem
