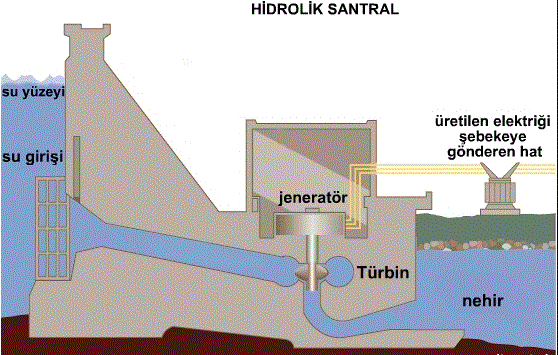
hidrojen
Periyodik çizelgenin IA sütunun ilk sırasında yeralan kimyasal element. Suyun bileşimine giren gaz halinde, yalın bir cisim olan hidrojenin simgesi H, atom sayısı 1, atom ağırlığı 1,007825’tir. Evrende çok yaygın bir kimyasal elementtir: Güneş ve yıldızlar, aşağı yukarı bütünüyle hidrojenden oluşmuştur. Yerküre’deyse hidrojen çeşitli bileşikler halinde, özellikle su ve organik maddeler halinde bulunur. Dolayısıyla^ söz konusu bileşiklerden, genellikle de sudan elde edilir ve yakıldığında su açığa çıkar. Zaten hidrojen sözcüğü, “su doğuran” anlamı taşımaktadır.
Hidrojeni ilk olarak 1766’da İngiliz bilgini Cavendish yalıtmış؛. Fransız fizikçisi Charles, 1783’te balonunu şişirmek için bol miktarda hidrojen üretmiş, İskoçyalı Dewar, 1898’de bu gazı sıvılaştırırken, 1924’te MieczysIaw Wolfke, katılaştırmayı başarmıştır.
Hidrojen, günümüzde suyun elektrolizi yoluyla ko- layca üretilebilir. Bu amaçla önce bir asit, sözgelimi sül- fürik asit ya da sodyum hidroksit gibi bir baz katılarak, su, elektrik akımı ileten bir çözelti haline getirilir. Böyle- ce elde edilen çözeltiden akım geçirilirse, eksi kutba bağlı elektrotta yani katotta hidrojen, anottaysa oksijen açığa çıkar. Bu yöntemle elde edilen hidrojenin hacmi, oksijenin iki katına ulaşır.
Ayrıca, çinko ve demir gibi metallerin üstüne hidro- klorik asit ya da sülfürik asit çözeltileri dökülerek de hid- rojen elde edilebilir. Kuşkusuz, açığa çıkan gazı tppla- mak için uygun bir düzenek kullanmak zorunludur. La- boratuvarlarda bu amaçla Kipp aygıtından yararlanılır.
Sanayideyse, su buharı karbonla indirgenerek ya da kömür ve doğal gaz (özellikle metan) ayrıştırılarak hid- rojen üretilir.
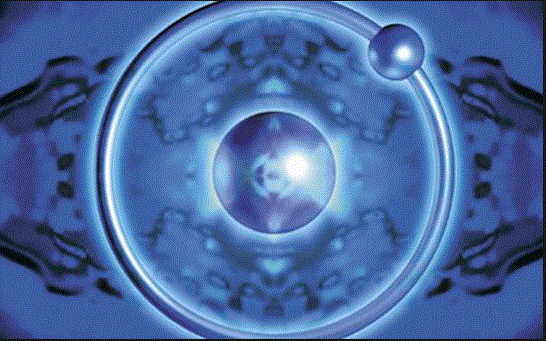
Hidrojenin birçok özelliği, atomunun bütün öbür atomlardan daha küçük ve daha yalın oluşundan kay- naklanır. Atomu, tek protonlu bir çekirdek ile çekirdeği çevresinde dönen bir elektrondan oluşur; bu elektron bazı koşullarda atomdan ayırılabilir ve o zaman atom, bir protona yani asit nitelikli H+ iyonuna dönüşür.
Hidrojen atomları ikişer ikişer birleşerek, H2 hidro- jen molekülünü oluştururlar. Hidrojen gazında bulu- nan, bu moleküllerdir. Hidrojen sıvılaştırılabilir; ama sı- vılaşması için çok düşük, sözgelimi, normal basınç al- tında -252,7 °c sıcaklık ister. Daha düşük sıcaklıkta sıvı- laşan tek gaz, bir soy (asal) gaz olan helyumdur.
Çok hafif moleküllerden oluşması nedeniyle hidrojen gazı, yoğunluğu en düşük olan gazdır. Sözgelimi havanın yoğunluğu, hidrojenden ٦ 4,5 kat büyüktür. Bu yüzden, günümüzde meteorolojide kullanılan sondaj balonları hidrojenle şişirilir; eskiden, güdümlü balonlar da aynı gazla doldurulurken, hidrojenin çabuktutuşma özelliği yüzünden doğan kazalar, güdümlü balonlarda kullanımına son verilmesine yol açmıştır.
Hidrojenin bir başka özelliği de, çok hafif oluşuna bağlanır. Fizikte, bir gazın ne kadar hafif olursa, göze- nekli bir çeperi o ölçüde kolay geçeceği kanıtlanmıştır. Sözgelimi, hidrojen bulunan birtüpün ağzı kurutma kâ- ğıdı gibi gözenekli birfiltre kâğıdıyla kapatılıp, yanan bir kibrit tüpe yaklaştırıldığında, tüp dışında gazın tutuştu- ğu görülür; çünkü gaz, gözenekli kâğıttan geçmiştir. Hidrojen atomlarının küçüklüğünden kaynaklanan da- ha şaşırtıcı bir olay da, bu gazın 500 °c sıcaklığa kadar ısıtılmış platin çeperden sızabilmesidir.
Hidrojen, soluk mavi bir alevle yanar ve yanma sonucunda su buharı oluşur. Bu tepkime, aşağıdaki kimyasal denklemle gösterilebilir:
1 H2 + 02 -» 2 H20
Söz konusu tepkimede, ayrıca büyük ölçüde ısı açığa çıkar.
Oksijen hamlaçlarında (kaynak aygıtı), bu ısıdan yararlanılır. Hidrojen ve oksijen, ancak hamlaç ucunda birbiriyle karışır. Ne var ki, bu gazları doğrudan doğru- ya karıştırmaktan kaçınmak gerekir; çünkü karışım oranı bir hacim oksijen ve iki hacim hidrojen olduğunda, güçlü bir patlayıcı madde ortaya çıkar. Ayrıca, alev bulunmasa bile patlama tepkimesi gerçekleşebilir; bunun için karışıma az miktarda platin köpüğü (çok gözenekli platin) katmak yeterlidir.
Alevsiz ve patlamasız çalışan yakıtlı pillerde, bu iki gaz kullanılır. Söz konusu pillerde, tepkime sırasında açığa çıkan ı؟ı enerjisi, doğrudan doğruya elektrik enerjisine dönüşür.
hidrojenin oksijenle verdiği tepkimenin şiddeti, oksijenle bileşme eğiliminin çok yüksek olduğunu göste- rir; dolayısıyla çok güçlü bir indirgeyicidir. Sözgelimi, yaklaşık 300 °C’a kadar ısıtılıp, üstünden hidrojen akımı getirilirse, bakır oksit indirgenerek, bakır ve su buharı açığa çıkar.
Daha yüksek sıcaklıklarda, başka oksitler de hidrojenle indirgenebilir. Bu bakımdan en ilgi çekici olan, demir oksittir; çünkü,demirvedemiralaşımlarını(dökme demir, elik) demir oksitten elde etmek için başvurulan çok karmaşık işlemlerin yerini bu tepkime alabilir. Buna karşılık silis, alümin, sönmemiş kireç gibi bazı ok- sitler, hidrojenle indirgenemez; çünkü bu bileşiklerde oksijen, öbür elementlere çok güçlü biçimde bağlan-
©ksijen gibi klor da, hidrojenle patlama tepkimesi doğurur. Bu tepkimenin oluşması için, karışımı Güneş ışığına ya da morötesi ışınlara tutmak yeterlidir. Söz konusu tepkime sonucunda, hidroklorik asit (HCI) gazı açığa çıkar. Ayrıca, hidrojen, azotla da tepkimeye girer; bu tepkime daha zayıf olmasına karşın, amonyağın kimyasal bireşimini sağlar; dolayısıyla, sanayide hidrojenin bu özelliği büyük önem taşır.
Bütün bu nitelikleri, hidrojenin sanayide büyük ölçüde kullanılmasına yol açmıştır; bunlar arasında yağın kimyasal bireşimi, hidroklorik asit üretimi, yağların kokusunu almak için hidrojenleme işlemi, alkolün hazırlanması, oksijen kaynağında ve bazı füzelerde yakıt olarak kullanımı sayılabilir.